3.1. Il secondo principio della termodinamica
Il secondo principio della termodinamica è uno dei postulati su cui si basa la termodinamica classica.
Al contrario del primo principio e del principio zero questo postulato non descrive cosa il sistema può fare o come lo fa, ma stabilisce l’impossibilità di una certa classe di fenomeni.
Il primo principio della termodinamica non pone alcun limite alla conversione del lavoro in calore e viceversa. In un qualsiasi processo termodinamico è possibile avere come risultato la conversione del lavoro in calore come anche del calore in lavoro (conservazione dell'energia). È possibile convertire lavoro in calore senza alterare lo stato termodinamico del sistema, come negli esempi che seguono.
Nel primo, il sistema è costituito da un blocco che scivola su un piano con attrito, mentre la riserva di calore è rappresentata dall’aria.
Il lavoro della forza di attrito aumenta l'energia interna del blocco e, localmente, all’interno del piano di scorrimento c’è un aumento della temperatura del blocco e del piano.
Si sviluppa un flusso di calore dal blocco e dal piano verso l’aria dell’ambiente, senza comunque che la temperatura dell’aria cambi apprezzabilmente. Il sistema blocco-piano di scorrimento ritornano nello stato termodinamico iniziale.
 Nel secondo esempio, invece, il sistema è costituito da un pendolo che oscilla nell’aria e si ferma a causa dell’attrito, mentre la riserva di calore è ancora rappresentata dall’aria.
Nel secondo esempio, invece, il sistema è costituito da un pendolo che oscilla nell’aria e si ferma a causa dell’attrito, mentre la riserva di calore è ancora rappresentata dall’aria.
Il lavoro della forza di attrito aumenta l'energia interna del pendolo e, quindi, anche la sua temperatura. Si sviluppa un flusso di calore dal pendolo verso l’aria dell’ambiente. La temperatura dell’aria non cambia apprezzabilmente.
Il lavoro è convertito integralmente in calore. Il sistema pendolo ritorna nello stato termodinamico iniziale.
Infine, nel terzo esempio il sistema è costituito da una resistenza elettrica, mentre la riserva di calore dall’acqua di un lago.
Il lavoro, di origine elettrica, aumenta l'energia interna, e quindi la temperatura, della resistenza elettrica.
Si produce un flusso di calore dalla resistenza all’acqua del lago. La temperatura del lago non cambia apprezzabilmente.
Il lavoro è convertito integralmente in calore. Le coordinate termodinamiche del sistema non subiscono alcuna variazione. La trasformazione del lavoro in calore può proseguire all’infinito.
Sono possibili le trasformazioni inverse a quelle sopra descritte?
Per quanto riguarda il primo principio la risposta dovrebbe essere affermativa: l'energia si conserva anche nei processi inversi ... che però nella realtà non si osservano mai!Bisogna quindi introdurre un altro principio, indipendente dal primo: è proprio il secondo principio che pone un'ulteriore condizione alle trasformazioni termodinamiche. Esistono diversi enunciati del secondo principio della termodinamica, tutti equivalenti, e ciascuna delle formulazioni ne mette in risalto un particolare aspetto.
Il secondo principio definisce una nuova funzione di stato: l'entropia. L'entropia si può pensare come la misura di quanto un sistema sia vicino allo stato di equilibrio, o in modo equivalente come la misura del grado di disordine di un sistema.
Il secondo principio afferma che l'entropia di un sistema isolato non può diminuire.Pertanto, quando un sistema isolato raggiunge una configurazione di massima entropia non può subire trasformazioni: ha raggiunto l'equilibrio.
A causa della sua validità universale, il secondo principio pone dei limiti a quello che può accadere in qualunque processo. A questo proposito è utile sottolineare come fra il primo e il secondo principio della Termodinamica, quello che governa il mondo, quello che stabilisce come devono andare le cose, quello che 'comanda' insomma, non è il principio di conservazione dell'energia, ma il principio di aumento dell'entropia. Infatti il secondo principio determina quali sono i processi che possono accadere, mentre il primo principio si 'limita' ad affermare che, all'interno di quei processi, il bilancio energetico deve andare in pareggio!
3.2. Enunciati di Clausius e di Kelvin
Il primo principio della termodinamica è un principio di conservazione dell'energia: sancisce semplicemente che, qualunque trasformazione subisca un sistema isolato, la sua energia totale deve rimanere costante. Non ci sono, dunque, nel primo principio, limitazioni relative alle trasformazioni da una forma di energia all'altra; in particolare nessuna limitazione è posta alle trasformazioni di lavoro in calore o di calore in lavoro, ne agli scambi di calore tra corpi. In realtà, mentre è sempre possibile trasformare il lavoro in calore (un corpo può sempre essere scaldato per attrito), il processo inverso è invece sottoposto a limitazioni. Se non fosse così allora sarebbe possibile utilizzare le sconfinate riserve di energia termica contenute negli oceani, nell'atmosfera, nelle acque dei laghi: questi si raffredderebbero (molto poco) e noi avremmo risolto tutti i nostri problemi energetici. Questo non è possibile. Così come non è possibile, senza spendere lavoro meccanico, trasferire calore da un corpo ad una certa temperatura ad un altro a temperatura più alta (cosicchè il corpo freddo si raffredderebbe ulteriormente e quello caldo si scalderebbe). Le due classi di fenomeni hanno evidentemente qualcosa in comune: entrambe indicano che le trasformazioni naturali hanno una direzione preferenziale (il lavoro si trasforma spontaneamente in calore, il calore fluisce spontaneamente dai corpi caldi a quelli freddi). Verso la metà dell'Ottocento, questa "constatazione sperimentale" portò a due fondamentali formulazioni del secondo principio della termodinamica.3.2.1. Enunciato di Lord Kelvin (Kelvin-Planck)
"E' impossibile realizzare una trasformazione il cui unico risultato sia una trasformazione in lavoro di calore tratto da una sorgente a temperatura uniforme". 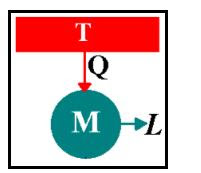
Attenzione alle parole "unico risultato". Se infatti consideriamo l'espansione isoterma di un gas perfetto, si ha che tutto il calore prelevato dalla sorgente calda si trasforma in lavoro (variazione dell'energia interna = 0, quindi Q=L, per il I principio).
Tuttavia questo non è l'unico risultato dal momento che il gas ha cambiato volume, quindi il postulato di Kelvin è salvo.
3.2.2. Enunciato di Clausius
"E' impossibile realizzare una trasformazione il cui unico risultato sia un passaggio di calore da un corpo a una data temperatura a un altro a temperatura più alta".

Anche qui non sono messe a caso le parole "unico risultato".
I due enunciati sembrano "enunciare" cose diverse, tuttavia, come abbiamo già notato, hanno qualcosa in comune, anzi, si può dimostrare che sono del tutto equivalenti.3.3. Il terzo principio della termodinamicaE’ strettamente legato al secondo, è in alcuni casi è considerato come una conseguenza di quest’ultimo. Può essere enunciato dicendo che è impossibile raggiungere lo zero assoluto con un numero finito di trasformazioni e fornisce una precisa definizione della grandezza chiamata entropia.3.4. L’entropia
In termodinamica l'entropia è una funzione di stato che si introduce insieme al secondo principio della termodinamica e che viene interpretata come una misura del disordine di un sistema fisico o più in generale dell'universo. In base a questa definizione possiamo dire che quando un sistema passa da uno stato ordinato ad uno disordinato la sua entropia aumenta.
Nel Sistema Internazionale si misura in joule su Kelvin(J/K).
Il concetto di entropia venne introdotto agli inizi del XIX secolo, nell'ambito della termodinamica, per descrivere una caratteristica (la cui estrema generalità venne osservata per la prima volta da Sadi Carnot nel 1824) di tutti i sistemi allora conosciuti nei quali si osservava che le trasformazioni avvenivano invariabilmente in una direzione sola, ovvero quella verso il massimo disordine.
Il concetto di entropia venne introdotto agli inizi del XIX secolo, nell'ambito della termodinamica, per descrivere una caratteristica (la cui estrema generalità venne osservata per la prima volta da Carnot nel 1824) di tutti i sistemi allora conosciuti nei quali si osservava che le trasformazioni avvenivano invariabilmente in una direzione sola, ovvero quella verso il massimo disordine. 
In particolare la parola entropia venne introdotta per la prima volta da Rudolf Clausius nel suo Abhandlungen über die mechanische Wärmetheorie (Trattato sulla teoria meccanica del calore), pubblicato nel1864. In tedesco, Entropie, deriva dal greco εν, "dentro", e da τρoπή, "cambiamento", "punto di svolta", "rivolgimento" (sul modello di Energie, "energia"): per Clausius indicava quindi dove va a finire l'energia fornita ad un sistema. Propriamente Clausius intendeva riferirsi al legame tra movimento interno (al corpo o sistema) ed energia interna o calore, legame che esplicitava la grande intuizione del secolo dei Lumi, che in qualche modo il calore dovesse riferirsi al movimento di particelle meccaniche interne al corpo. Egli infatti la definiva come il rapporto tra la somma dei piccoli incrementi di calore, divisa per la temperatura assoluta durante l'assorbimento del calore.
Per chiarire maggiormente il concetto di entropia possiamo presentare alcuni esempi:
· Si pensi di far cadere una gocciolina d'inchiostro in un bicchiere d'acqua: quello che si osserva immediatamente è che, invece di restare una goccia più o meno separata dal resto dell'ambiente (che sarebbe uno stato completamente ordinato), l'inchiostro inizia a diffondere e, in un certo tempo, si ottiene una miscela uniforme (stato completamente disordinato). É esperienza comune che, mentre questo processo avviene spontaneamente, il processo inverso (separare l'acqua e l'inchiostro) richiederebbe energia esterna.
· Immaginiamo un profumo contenuto in una boccetta colma come un insieme di molecole puntiformi dotate di una certa velocità derivante dalla temperatura del profumo. Fino a quando la boccetta è tappata, ossia isolata dal resto dell'universo, le molecole saranno costrette a rimanere all'interno e non avendo spazio (la boccetta è colma) rimarranno abbastanza ordinate (stato liquido). Nel momento in cui la boccetta viene stappata le molecole della superficie del liquido inizieranno a staccarsi dalle altre ed urtando casualmente tra di loro e contro le pareti della boccetta usciranno da questa disperdendosi all'esterno (evaporazione). Dopo un certo tempo tutte le molecole saranno uscite disperdendosi. Anche se casualmente qualche molecola rientrerà nella boccetta il sistema complessivo è ormai disordinato e l'energia termica che ha messo in moto il fenomeno dispersa e quindi non più recuperabile.
L'entropia S come funzione di stato venne introdotta nel 1864 da Rudolf Clausius nell'ambito della termodinamica come
ΔS = ΔQrev/T
dove ΔQrev è la quantità di calore assorbito in maniera reversibile dal sistema a temperatura T.
In forma differenziale, la legge si presenta così:
ds = δQrev/T
È da notare come, mentre δQrev non è un differenziale esatto, dividerlo per la temperatura T lo rende tale:
1/T è dunque il fattore d'integrazione.
In una delle sue diverse formulazioni, il secondo principio della termodinamica afferma che in un sistema isolato l'entropia può solo aumentare, o al limite rimanere costante per trasformazioni termodinamiche reversibili.
Il collegamento che segue, permette di approfondire diverse definizioni di entropia.
http://it.wikipedia.org/wiki/Entropia_(termodinamica)#Definizione_termodinamica
3.5. Energia ed entropia
Assumendo che l'intero universo sia un sistema isolato - ovvero un sistema per il quale è impossibile scambiare materia ed energia con l'esterno - il primo ed il secondo principio della termodinamica possono essere riassunti da un'unica frase: “l'energia totale dell'universo è costante e l'entropia totale è in continuo aumento”, che valida per qualsiasi sistema isolato.
In altre parole ciò significa che non solo non si può né creare né distruggere l'energia, ma nemmeno la si può completamente trasformare da una forma in un'altra senza che una parte venga dissipata sotto forma di calore.
Se per esempio si brucia un pezzo di carbone, la sua energia si conserva e si converte in energia contenuta nell'anidride carbonica, nell'anidride solforosa e negli altri residui di combustione oltre che naturalmente in forma di calore. Per quanto non si sia persa energia nel processo, sappiamo che non possiamo invertire il processo di combustione e ricreare dai suoi scarti il pezzo di carbone originale.
La spiegazione si trova nel secondo principio della termodinamica che può così essere parafrasato:
“ogni volta che una certa quantità di energia viene convertita da uno stato ad un altro si ha una penalizzazione che consiste nella degradazione di una parte dell'energia stessa in forma di calore, in particolare questa parte non sarà più utilizzabile per produrre lavoro.”
Lo stato in cui l'entropia raggiunge il massimo livello e non vi è più energia libera disponibile per compiere ulteriore lavoro è detto stato di equilibrio. Per l'intero universo concepito come sistema isolato ciò significa che la progressiva conversione di lavoro in calore, per il principio di aumento dell'entropia totale che, a fronte di una massa dell'universo finita, porterà infine ad uno stato in cui l'intero universo si troverà in condizioni di temperatura uniforme; la cosiddetta morte termica dell'universo.
L'entropia caratterizza il verso di qualunque trasformazione reale come trasformazione irreversibile: infatti anche tornando da uno stato finale a uno identico allo stato iniziale (per temperatura, volume, pressione o altri parametri, come continuamente avviene nei cicli di una centrale) almeno una variabile fisica differirebbe dal punto da cui si è partiti, l'entropia (che inevitabilmente aumenta).
Ogni trasformazione reale è una trasformazione irreversibile perché l'entropia aumenta; l'ipotesi di idealità equivale appunto all'ipotesi di una variazione d'entropia nulla.
La figura sotto schematizza il fatto che tutti i processi naturali generano entropia, essendo l’entropia una misura del disordine e che i sistemi evolvono verso gli stati di massima probabilità termodinamica.

 "Una teoria è tanto più importante quanto maggiore è la semplicità delle sue premesse, quanto più diversi sono i tipi di cose che correla e quanto più esteso è il campo della sua applicabilità. Di qui, la profonda impressione che ho ricevuto dalla Termodinamica classica.
"Una teoria è tanto più importante quanto maggiore è la semplicità delle sue premesse, quanto più diversi sono i tipi di cose che correla e quanto più esteso è il campo della sua applicabilità. Di qui, la profonda impressione che ho ricevuto dalla Termodinamica classica.


























